מחקר חדש מגלה כי במחלת אלצהיימר, שבר של חלבון הקדם עמילואיד (APP-CTF) משבש תהליכים תאיים מרכזיים, ועלול לגרום למוות מוקדם של נוירונים. ממצא זה מצביע על כך שטיפולי AD צריכים להתמקד במניעת הצטברות APP-CTF.
APP-CTFs מפריעים לתקשורת בין האברונים, משבשים את האיזון הסלולרי.
אלצהיימר מחלה (AD) ממשיכה להיות מצב נוירודגנרטיבי משמעותי ונרחב, המשפיע על מיליונים ברחבי העולם. במחקר שפורסם לאחרונה ב תא התפתחותיחוקרים מהמעבדה של Wim Annaert (VIB-KU Leuven) זיהו מנגנון חדשני הקשור בפוטנציה לשלבים המוקדמים של AD.
הם הוכיחו כי שבר של חלבון הקדם עמילואיד (APP), הנקרא APP-CTF, משבש את התקשורת בין תאים תאיים החיוניים לאחסון סידן ולסילוק פסולת, שיכול להיות אירוע מוקדם שלפני מוות תאי עצב. ממצאים אלו, עם השלכות פוטנציאליות על פיתוח טיפולי AD חדשים, מצביעים על כך שיש לקחת בחשבון מניעת הצטברות APP-CTF כדי לפתח טיפולים יעילים יותר.
מחלת אלצהיימר מאופיינת באובדן מתקדם של תפקוד קוגניטיבי, פגיעה בזיכרון ושינויים התנהגותיים. אחד המאפיינים הנראים במוחם של אנשים עם מחלת אלצהיימר הוא היווצרותם של פלאק עמילואיד – גושים של פפטידים β-עמילואיד (Aβ), שהם תוצרים מפורקים של חלבון קדם עמילואיד (APP). מקטעי Aβ אלו מצטברים בנוירונים בשלב מוקדם של המחלה, עוד לפני שנצפית ירידה קוגניטיבית.
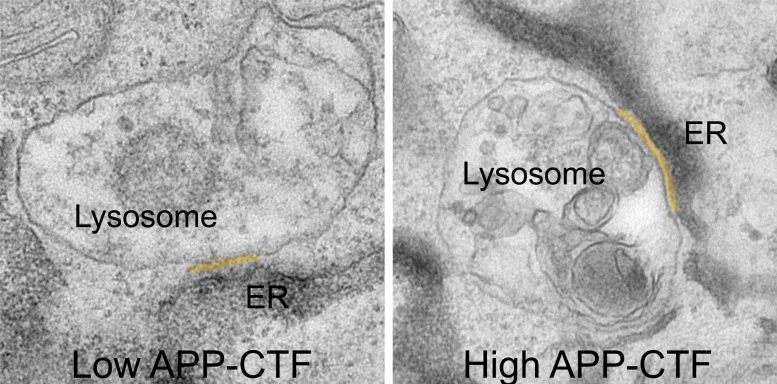
APP-C-Terminal Fragments (APP-CTFs) מצטברים בין הרשת האנדופלזמית לליזוזומים. קרדיט: VIB
עם זאת, מחקר חדש מצביע על כך שייתכן שאפילו אירועים מוקדמים יותר מתרחשים במוח AD לפני היווצרות הפלאק וכי חלבון APP ממלא תפקיד בשלבים מוקדמים אלו. המנגנון מאחורי זה נשאר בגדר תעלומה עד עכשיו.
במחקר האחרון שלהם, המעבדה של Wim Annaert במרכז VIB-KU לובן לחקר מוח ומחלות זיהתה מנגנון המסביר כיצד APP עשוי לתרום לשלבים מוקדמים אלו של AD. תגלית זו עשויה להוביל לכיוון חדש בגישות המחקר והטיפול ב-AD.
שיבוש תקשורת סלולרית
APP נמצא בממברנות התא של תאי המוח. המוח מייצר כל הזמן מולקולות APP חדשות תוך פירוק והסרה של מולקולות ישנות. תהליך זה כרוך במספריים אנזימטיים, כאשר גמא-סיקרטאז הוא האחרון שיוצר את פפטידי Aβ הידועים והנחקרים היטב ב-AD.
במשך זמן רב חשבו שחסימת גמא-סקרטאז תהיה הצעד ההגיוני למניעת ייצור שברי Aβ רעילים. עם זאת, זה מוביל להצטברות של המבשר שלהם, APP-C-Terminal Fragments, או APP-CTFs. כעת, החוקרים גילו שהשברים הללו רעילים גם לנוירונים. נראה שהם מצטברים בין הרטיקולום האנדופלזמי (ER), המדור החיוני לסינתזת שומנים ואגירת סידן, לבין הליזוזומים, מה שנקרא 'פחי הפסולת' של נוירונים, שהם קריטיים לפירוק תוצרי הפסולת של התא.
"על ידי כך, APP-CTFs משבשים את האיזון העדין של סידן בתוך ליזוזומים", מסבירה ד"ר Marine Bretou, הכותבת הראשונה של המחקר. "ההפרעה הזו מעוררת מפל אירועים. ה-ER כבר לא יכול למלא מחדש ביעילות ליזוזומים בסידן, מה שמוביל להצטברות של כולסטרול ולירידה ביכולתם לפרק פסולת סלולרית. זה גורם לקריסת כל המערכת האנדוליזוזומלית, מסלול חיוני לשמירה על נוירונים בריאים".
המחקר החדש תומך עוד בכך ש-APP-CTFs הנובעים מדיכוי גמא-secretase עשויים למעשה להיות האשם מאחורי הפרעה בתפקוד האנדוליזוזומלי, כפי שנצפה בשלבים המוקדמים מאוד של AD.
שינוי פרדיגמה בהבנת השלבים המוקדמים של פתוגנזה של AD
מחקר זה מקדם באופן משמעותי את ההבנה שלנו לגבי הגורמים הפוטנציאליים למחלה בשלבים המוקדמים של AD. תוצאה יוצאת דופן של מחקר זה היא ששלבים מוקדמים אלו עלולים להיגרם על ידי קטע אחר של אותה מולקולת APP ולא מ-Aβ. יש לכך השלכות משמעותיות על הגישות הטיפוליות הנוכחיות שמטרתן לנקות את מוח ה-AD מפלאקים עמילואידים, שכן הם נוטים להתעלם מההשפעות הרעילות של שברים אחרים. ניסיונות אחרים מתמקדים בחלבוני טאו או דלקת עצבית, שהם סימני היכר אחרים של התקדמות AD המכוונים לאירועים מאוחרים יותר. עם זאת, התערבות מוקדמת היא ככל הנראה המפתח לעצירה או אפילו מניעת AD.
"כישלון הניסויים הקליניים בשימוש במעכבי גמא-סקרטאז עשוי להיות מוסבר בכך שהתמקדנו רק בגורם אחד ובשלב מאוחר מדי במחלה", מסביר פרופ' וים אנארט, הכותב הראשי של המחקר. "ממצאי המחקר שלנו מצביעים על כך שמאפננים גמא-סקרטאז, שיכולים לעזור לקדם פינוי של APP-CTFs רעילים מבלי לחסום את האנזים לחלוטין, עשויים להיות יעד רלוונטי יותר להתערבות מוקדמת ב-AD. המפתח עשוי להיות מציאת האיזון הנכון בין פינוי APP-CTF ומניעת פלאק."
במבט קדימה, המדענים מצטרפים למאמצים עם עמיתים לפתח מאפננים אלה על בסיס תובנות חדשות אלה וימשיכו לחקור הומאוסטזיס תאי בשלבים המוקדמים של AD.
המחקר מומן על ידי Fondation Recherche Alzheimer – Stichting Alzheimer Onderzoek (STOPALZHEIMER.BE), האגודה לאלצהיימר ותוכנית FWO.

