ניסויי ניוטרונים עזרו לחשוף את המנגנון האנזימטי של פחמן אחד המסנתז מקורות מזון חיוניים לתאים סרטניים התלויים בויטמין B6, ומספק תובנות מפתח לגבי תכנון תרופות חדשות להאטת התפשטותם של סוגי סרטן אגרסיביים. קרדיט: Jill Hemman/ORNL, משרד האנרגיה האמריקאי
מדענים במעבדה הלאומית של Oak Ridge מקדמים את מחקר הטיפול בסרטן על ידי תכנון תרופות המכוונות למסלולים המטבוליים שתאים סרטניים מסתמכים עליהם לגדילה. על ידי מיפוי המבנה של אנזים מפתח עם נויטרונים וקרני רנטגן, הם שואפים לפתח טיפולים לסוגי סרטן אגרסיביים, כולל סרטן ריאות וסרטן השד.
לאחר מסע מחקר שזכה לשבחים רבים שעיצב מחדש בהצלחה תרופה להפטיטיס C לאחד מהטיפולים התרופתיים המובילים עבור COVID 19מדענים במעבדה הלאומית של אוק רידג' של משרד האנרגיה מפנים כעת את גישת עיצוב התרופות שלהם לסרטן.
במחקר שנערך לאחרונה, שפורסם בכתב העת כימיה של תקשורתהצוות השתמש בניוטרונים וקרני רנטגן כדי לצייר מפת דרכים של כל אחד מהם אָטוֹםקשר כימי ומטען חשמלי בתוך אנזים מפתח ששייך למסלול מטבולי שתאים סרטניים משתמשים בו באופן דרמטי כדי להתרבות.
מידע חדש זה בעצם עוזר לסלול את הדרך לפיתוח תרופות חדשות הפועלות כחסימות דרכים לאורך המסלול המטבולי כדי לנתק את אספקת המשאבים החיוניים לתאי הסרטן. התרופות נועדו לכוון לסרטן יוצרי גידולים אגרסיביים ביותר שלעתים קרובות מדי הופכים לסופניים, כגון סרטן ריאות, מעי גס, שד, לבלב וסרטן הערמונית.
הבנת סרטן ברמה האטומית
"עם יותר מ-200 סוגים, סרטן ממשיך להיות מחלה הרסנית", אמר המדען הבכיר ב-ORNL, אנדריי קובלבסקי. "זה אומר שאם אי פעם ננצח את המחלה, זה ידרוש בדיקה של כל אפשרות וללמוד כל היבט של המחלה בכל רמה – מגידולים, תאים ומולקולות ועד לאטומים בודדים."
קובלבסקי אמר כי מחקר זה מייצג עניין מחודש בחקר מסלולים מטבוליים כמטרות לפיתוח טיפולים תרופתיים נגד סרטן. מסלולים מטבוליים הם סדרה של תגובות כימיות בתוך תא שבהן התוצר של תגובה אחת הופך לחומר הבסיס, או המצע, לתגובה הבאה.
מסלול ספציפי שמעניין את קובלבסקי וצוותו הוא מסלול חילוף החומרים של פחמן אחד, או 1C, המשתמש באנזימים המעבירים יחידות פחמן מביומולקולה אחת לאחרת. לפעולה זו יש תפקיד מכריע בסינתזה של מולקולות ביולוגיות חשובות כגון חומצות אמינו, DNA ו RNA. במילים אחרות, יחידות 1C הן כמו מקורות דלק שהתאים צריכים כדי לגדול ולהתרבות. זה גם אומר שהם חיוניים גם להתרבות בלתי נשלטת של תאים סרטניים.
"המחקר הזה מעניין בכך שהמולקולות שאנו מתכננים לעצב יהיו תרופות מטבוליות, שהיו חלק מהתרופות הראשונות – כמו מתוטרקסט – שפותחו לטיפול בסרטן. במהלך השנים, המחקר הלך לכיוונים אחרים כדי לחקור מסלולים אחרים", אמר קובלבסקי. "אבל לאחרונה חלה התחדשות, או חזרה, לתרופות המטבוליות כי אתה באמת צריך שפע של אפשרויות התערבות שונות, לפעמים בו-זמנית כדי להילחם בכל סוגי הסרטן השונים."
עיצוב תרופות חלוצי עם פיזור ניוטרונים
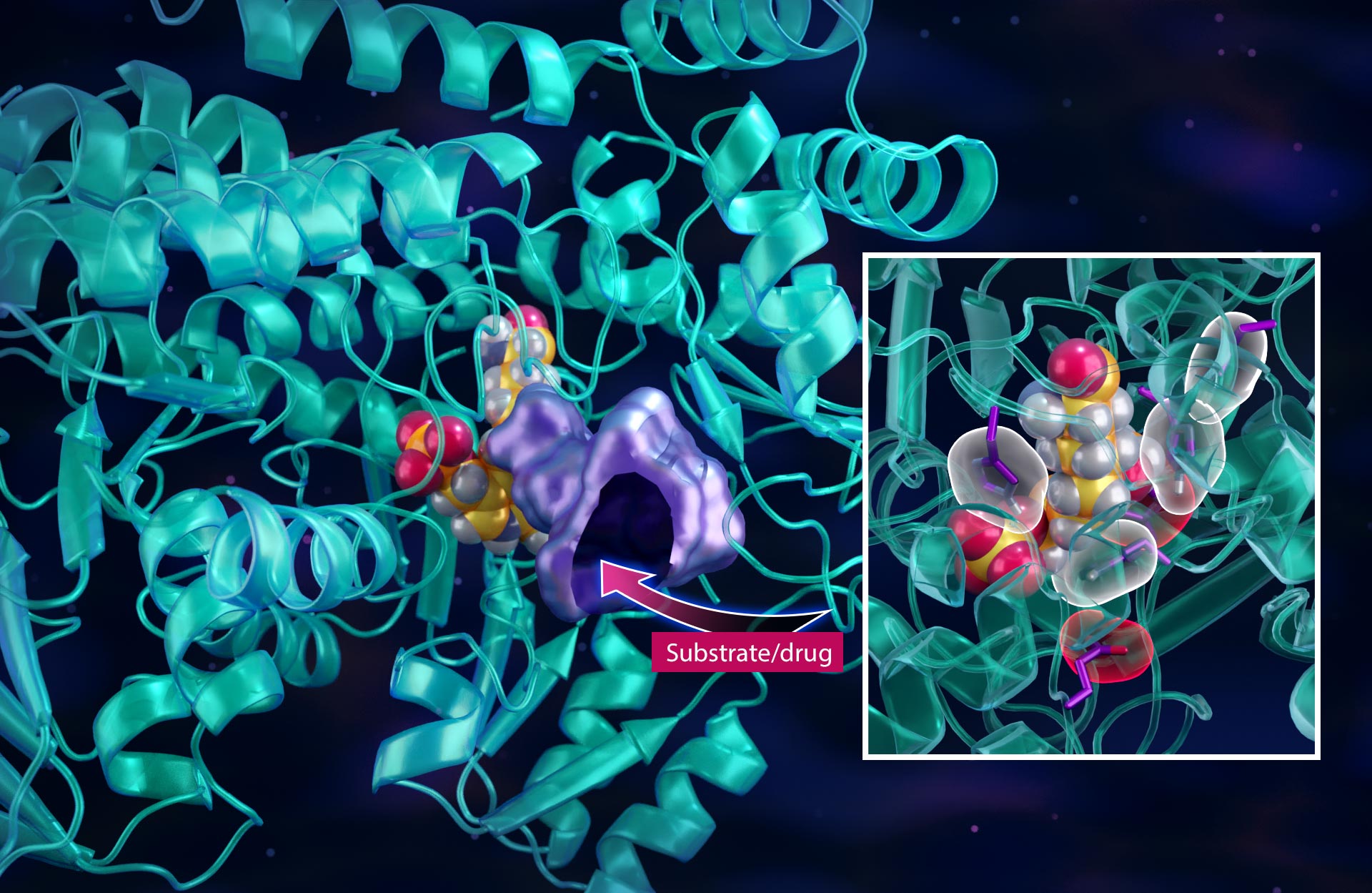
אחד האנזימים החיוניים במסלול 1C הוא סרין הידרוקסי-מתיל-טרנספראז, או SHMT. SHMT אחראי ליזום חלק הארי של תגובות 1C עבור התא. וכרגע, לא קיימות תרופות אנטי-סרטניות מאושרות המכוונות ל-SHMT באופן ספציפי.
"מסלול חילוף החומרים 1C 'נחטף' על ידי סוגים רבים של סרטן. אם אתה חושב על המסלול הזה כעל כביש מהיר, SHMT הוא הסרטן שנדרש כדי לחטוף תנועה", אמרה חוקרת הפוסט-דוקטורט ויקטוריה דראגו, המחברת הראשית של המחקר. "חסימת האנזים באמצעות מעכבים או 'מחסומים' מונעת מתאי סרטן להשתמש בכביש המהיר, מנתקת ביעילות את אספקת הדלק שלהם, ובכך מונעת מהם להתפשט".
אבל תכנון תרופה דורש הבנה מפורטת של מבנה האנזים וכיצד המבנה תומך בתפקודו ברמה האטומית. לשם כך, הצוות השתמש בשילוב של ניסויי פיזור נויטרונים וקרני רנטגן כדי למפות את מיקומו של כל אטום במבנה האנזים וכן את רשת הקשרים הכימיים והמטענים החשמליים המתאימים.
הידיעה כיצד מולקולות קטנות מתחברות לאנזים היא המפתח לעיצוב מולקולות סמים תואמות – כמו חיבור חלקי פאזל בתלת-ממד – אבל החלקים צריכים לא רק להתאים בצורתם אלא גם במטען החשמלי. קובלבסקי השווה את זה לשימוש בסוללה הנכונה עם הגודל והכיוון הנכון כדי להפעיל מכשירים אלקטרוניים ספציפיים.
בניגוד לקרני רנטגן, הרגישות יותר ליסודות כבדים כמו פחמן, נויטרונים אידיאליים לחקר יסודות קלים כמו מימן והם שימושיים בקביעת המטענים החשמליים ובמיפוי האינטראקציות בין אנזים לתרופה.
נויטרונים חשובים במיוחד בכך שאטומי מימן מהווים כ-50% מכלל האטומים במערכות ביולוגיות, ולנוכחותם יש גם תפקיד משמעותי בקביעת חוזק הקשרים הכימיים בין מולקולת תרופה לאנזים.
כדי לעקוב אחר אטומי המימן, החוקרים השתמשו במכשירי הנייטרונים MANDI ו-IMAGINE ב-Spallation Neutron Source של ORNL, או SNS, ו-High Flux Isotope Reactor, או HFIR. ניסויי הנייטרונים אפשרו לצוות לראות כיצד האנזים SHMT קושר את המולקולה הפיזיולוגית שלו – סרין אמינו חוּמצָה – ליזום את התגובה הכימית, כמו גם כיצד האנזים מכוון את העברת האטומים בשלבים הקריטיים המובילים לרצף התגובה המורכב. חשוב מכך, המחקר אישר כיצד ניתן ללכוד סרין ממש לפני שהוא עובר לכיס שבו מתרחשת התגובה הכימית.
"היו הצעות לאורך השנים לגבי המנגנון הקטליטי של האנזים וכיצד הוא פועל, אבל עכשיו אנחנו יודעים בוודאות", אמר קובלבסקי. "רק על ידי איתור כל האטומים באתר הפעיל לאורך מסלול התגובה של האנזים הזה אנו משיגים את הידע הדרוש לנו כדי לעצב תרופות טובות יותר שיוסיפו לאסטרטגיות ההתערבות המרובות למלחמה בסרטן."
המחקר מהווה צעד ראשון משמעותי בדרך למימוש טיפול תרופתי חדשני. השלבים הבאים בקמפיין המחקר כוללים לימוד האנזים בשלבי תגובה שונים ובדיקתו מול מעכבי תרופות קיימים.
מחקר הנייטרונים הוא חלק ממאמץ גדול יותר הממומן על ידי ה המכונים הלאומיים לבריאות לחקור מחלקה רחבה של אנזימים הדומים ל-SHMT המסתמכים על נגזרת יחידה של ויטמין B6 לבצע יותר מ-140 תגובות כימיות שונות.
"ייצור היתר של SHMT נקשר לירידה נוספת של חולים הסובלים מצורות אגרסיביות של סרטן", אמר דראגו. "פיתוח טיפול יעיל יותר שמפחית את קצב התקדמות הסרטן יכול להיות בדיוק הדבר שעושה את כל ההבדל בחייו של מישהו."
בנוסף לקובלבסקי ודרגו, מחברי המחקר כוללים את קלאודיה קמפוס, מתאה הופר, אלייה קולינס, אוקסנה גרליטס, קווין ל. וייס, מתיו פ. בלייקלי ורוברט ס. פיליפס. מדידות נויטרונים וקרני רנטגן משלימות בוצעו ב-Institut Laue-Langevin, צרפת, וב-Advanced Photon Source, או APS, במעבדה הלאומית של Argonne.
HFIR, SNS ו-APS הם מתקני משתמש של משרד DOE of Science.