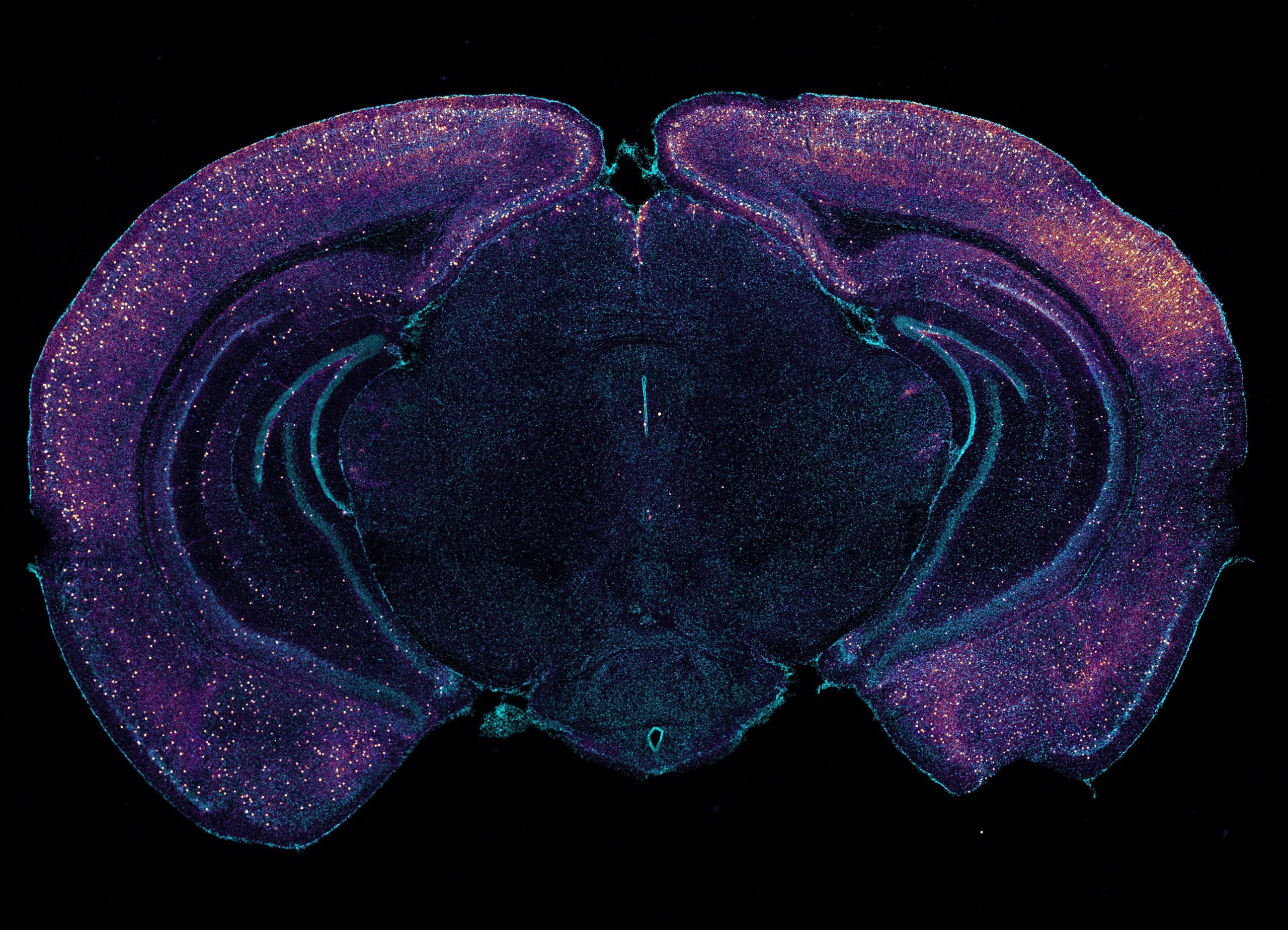
צביעה בהירה מדגישה אינטרנוירונים המבטאים VIP בחתך עטרה זה של מוח עכבר. הנוירונים עשויים לעזור להניע פינוי גלימפטי של עמילואיד באמצעות שחרור פפטידים. קרדיט: Tsai Laboratory/MIT Picower Institute
הפעלת גל מוחי ספציפי באמצעות טיפול באור וקול משפרת את שחרור הפפטידים מאינטרנוירונים, ומעודדת את הסרת חלבונים הקשורים לאלצהיימר דרך מערכת הגלימפה של המוח, על פי מחקר עדכני.
מחקר מ MIT ומוסדות אחרים מראים יותר ויותר שהבהוב אור ולחיצת צליל בתדר קצב המוח גמא של 40 הרץ עשויים להאט את התקדמות אלצהיימר מחלה (AD) והקלה על תסמינים הן אצל מתנדבים אנושיים והן בעכברי מעבדה.
במחקר חדש ב טֶבַע באמצעות מודל עכבר של המחלה, חוקרים ממכון Picower for Learning and Memory של MIT חושפים מנגנון מפתח שעשוי לתרום להשפעות מועילות אלה: פינוי חלבוני עמילואיד, סימן היכר של פתולוגיית AD, דרך מערכת הגלימפה של המוח, גילה רשת "צנרת" במקביל לכלי הדם של המוח.
"מאז שפרסמנו את התוצאות הראשונות שלנו ב-2016, אנשים שאלו אותי איך זה עובד? למה 40 הרץ? למה לא איזה תדר אחר?" אמר מחבר המחקר הבכיר לי-הואי צאי, פרופסור למדעי המוח של פיקוור ומנהל מכון פיקוור ויוזמת המוח המזדקן של MIT. "אלה אכן שאלות חשובות מאוד שעבדנו קשה מאוד במעבדה כדי לטפל בהן".
המאמר החדש מתאר סדרה של ניסויים, בראשות מיץ' מרדוק כשהיה דוקטורנט למדעי המוח והקוגניציה ב-MIT, המראה שכאשר גירוי גמא חושי מגביר את העוצמה והסנכרון של 40 הרץ במוחם של עכברים, הדבר גורם לסוג מסוים של נוירון לשחרור פפטידים. תוצאות המחקר מצביעות עוד יותר על כך שאותות חלבון קצרים אלה מניעים תהליכים ספציפיים המקדמים פינוי עמילואיד מוגבר דרך מערכת הגלימפה.
"אין לנו עדיין מפה ליניארית של הרצף המדויק של האירועים המתרחשים", אמר מרדוק, אשר היה בפיקוח משותף של צאי ומחבר שותף ומשתף פעולה אד בוידן, י. אווה טאן פרופסור לנוירוטכנולוגיה ב-MIT, חבר ב-MIT מכון מקגוברן לחקר המוח וחבר ב-The Picower Institute. "אבל הממצאים בניסויים שלנו תומכים במסלול הפינוי הזה דרך נתיבי הגלימפה העיקריים."
מגמא לגלימפטיקה
מכיוון שמחקר קודם הראה שמערכת הגלימפטית היא צינור מפתח לפינוי פסולת מוח ועשויה להיות מווסתת על ידי מקצבי מוח, הצוות של צאי ומרדוק שיער שזה עשוי לעזור להסביר את התצפיות הקודמות של המעבדה שגירוי גמא חושי מפחית את רמות העמילואיד בעכברי מודל אלצהיימר .
עבודה עם עכברי "5XFAD", המדגמים גנטית אלצהיימר, מרדוק ומחברים משותפים שיחזרו לראשונה את התוצאות הקודמות של המעבדה לפיהן גירוי חושי של 40 הרץ מגביר את הפעילות העצבית של 40 הרץ במוח ומפחית את רמות העמילואיד. אחר כך הם יצאו למדוד אם יש שינוי כלשהו בקורלציה של הנוזלים שזורמים דרך מערכת הגלימפה כדי לסחוב פסולת. ואכן, הם מדדו עליות בנוזל השדרה ברקמת המוח של עכברים שטופלו בגירוי גמא חושי בהשוואה לבקרות שלא טופלו. הם גם מדדו עלייה בשיעור הנוזל הבין-תאי היוצא מהמוח. יתרה מכך, בעכברים שטופלו בגמא, הוא מדד קוטר מוגבר של כלי הלימפה המנקזים את הנוזלים ומדד הצטברות מוגברת של עמילואיד בבלוטות הלימפה הצוואריות, שהוא מקום הניקוז לזרימה זו.
סיור וידאו של דגשים מתוך מאמר חדש מאת Murdock, et. אל. ממכון פיקואר ללמידה וזיכרון. קרדיט: מכון Picower ללמידה וזיכרון ב-MIT
כדי לחקור כיצד עשויה להתרחש זרימת נוזלים מוגברת זו, הצוות התמקד בתעלת המים של אקוופורין 4 (AQP4) של תאי אסטרוציטים, המאפשרת לתאים להקל על חילופי נוזלים גלימפטיים. כאשר הם חסמו את תפקוד APQ4 עם כימיקל, זה מנע מגירוי גמא חושי להפחית את רמות העמילואיד ומנע ממנו לשפר את הלמידה והזיכרון של העכבר. וכאשר, כבדיקה נוספת, הם השתמשו בטכניקה גנטית לשיבוש AQP4, זה גם הפריע לפינוי עמילואיד מונע על ידי גמא.
בנוסף לחילופי הנוזלים המקודמים על ידי פעילות APQ4 באסטרוציטים, מנגנון נוסף שבאמצעותו גלי גמא מעודדים זרימה גלימפטית הוא על ידי הגברת הפעימה של כלי דם שכנים. מספר מדידות הראו פעימות עורקים חזקה יותר בעכברים שהיו נתונים לגירוי גמא חושי בהשוואה לבקרות לא מטופלות.
אחת הטכניקות החדשות הטובות ביותר למעקב אחר האופן שבו מצב, כגון גירוי גמא חושי, משפיע על סוגי תאים שונים היא רצף שלהם RNA לעקוב אחר שינויים באופן שבו הם מבטאים את הגנים שלהם. באמצעות שיטה זו, הצוות של צאי ומרדוק ראה שגירוי חושי גמא אכן מקדם שינויים עקביים עם פעילות מוגברת של אסטרוציט AQP4.
מתבקש על ידי פפטידים
נתוני רצף ה-RNA חשפו גם כי בגירוי חושי גמא, תת-קבוצה של נוירונים, הנקראים "אינטרנוירונים", חוותה עלייה בולטת בייצור של מספר פפטידים. זה לא היה מפתיע במובן שידוע ששחרור פפטיד תלוי בתדרים של קצב המוח, אבל זה עדיין היה בולט מכיוון שפפטיד אחד במיוחד, VIP, קשור ליתרונות המאבק באלצהיימר ועוזר לווסת תאי כלי דם, זרימת דם ו פינוי גלימפטי.
בהסתמך על התוצאה המסקרנת הזו, הצוות ערך בדיקות שגילו VIP מוגבר במוחם של עכברים שטופלו בגמא. החוקרים השתמשו גם בחיישן של שחרור פפטיד וראו שגירוי גמא חושי הביא לעלייה בשחרור פפטיד מאינטרנוירונים המבטאים VIP.
אבל האם שחרור פפטיד מגורה גמא זה תיווך את הפינוי הגלימפטי של עמילואיד? כדי לגלות זאת, הצוות ערך ניסוי נוסף: הם כיבו את נוירוני ה-VIP באופן כימי. כאשר הם עשו זאת, ולאחר מכן חשפו עכברים לגירוי גמא חושי, הם גילו כי לא הייתה עוד עלייה בדופק העורקי ואין יותר פינוי עמילואיד מגורה בגמא.
"אנחנו חושבים שמעורבים נוירופפטידים רבים", אמר מרדוק. צאי הוסיף כי כיוון חדש ועיקרי למחקר של המעבדה יהיה לקבוע אילו פפטידים אחרים או גורמים מולקולריים אחרים עשויים להיות מונעים על ידי גירוי גמא חושי.
צאי ומרדוק הוסיפו כי בעוד מאמר זה מתמקד במה שככל הנראה מנגנון חשוב – פינוי גלימפטי של עמילואיד – שבאמצעותו גירוי גמא חושי מסייע למוח, זה כנראה לא המנגנון הבסיסי היחיד שחשוב. השפעות הפינוי שהוצגו במחקר זה התרחשו די מהר, אך בניסויי מעבדה ובמחקרים קליניים נדרשו שבועות או חודשים של גירוי גמא חושי כרוני כדי שיהיו השפעות מתמשכות על הקוגניציה.
עם כל מחקר חדש, לעומת זאת, מדענים לומדים יותר על האופן שבו גירוי חושי של מקצבי מוח עשוי לסייע בטיפול בהפרעות נוירולוגיות.
בנוסף לצאי, מרדוק ובוידן, מחברי העיתון האחרים הם צ'נג-יי יאנג, נה סאן, פינג-צ'יה פאו, כריסטינה בלאנקו-דוק, מרטין סי קאהן, ניקולאס ס. לאבוי, מתאוס ב. ויקטור, מד רזאול איסלאם. , פביולה גליאנה, נואל לירי, סידני וואנג, אדל בובניס, אמילי מא, ליילה א.אקאי, טאהיון קים, מדיסון סנב, יונג קיאן, קויקסין לאי, מישל מ' מקארתי, ננסי קופל, מנוליס קליס, קיריל ד' פיאטקביץ'.
התמיכה במחקר הגיעה מברברה ג'יי ווידון, הנרי אי סינגלטון, משפחת הובולו, רוברט א' ורנה אי בלפר, אדוארדו יורקיאן, משפחת קו האן, קרן משפחת קרול וג'ין לודוויג, קרן משפחת חאליס, לסטר א. גימפלסון, משפחת דולבי, ג'יי ל. וקרול ד' מילר, לורנס ודברה היליברנד, דיוויד ב. אמס, קרן מארק האס, מכון פיקאוור ללמידה וזיכרון, קרן JPB וה-JPB. המכונים הלאומיים לבריאות.