מחקרים מראים שדלדול המיטוכונדריה באקסונים של נוירונים מוביל להצטברות חלבון, גורם מפתח במחלות ניווניות, ומציע מטרה חדשה לטיפול. קרדיט: twoday.co.il.com
מסלול מפתח שזוהה כיצד דלדול המיטוכונדריה האקסונלית משבשת את האוטופגיה.
חוקרים מאוניברסיטת טוקיו מטרופוליטן זיהו כיצד חלבונים נאספים בצורה לא תקינה בנוירונים, תכונה של מחלות ניווניות כמו אלצהיימר. הם השתמשו בזבובי פירות כדי להראות שדלדול המיטוכונדריה באקסונים יכול להוביל ישירות להצטברות חלבון. במקביל, נמצאו כמויות גבוהות משמעותית של חלבון בשם eIF2β. החזרת הרמות לנורמה הובילה להתאוששות במחזור החלבון. ממצאים כאלה מבטיחים טיפולים חדשים למחלות נוירודגנרטיביות.
מפעל הסלולר: ייצור ופירוק חלבונים
כל תא בגופנו הוא מפעל עמוס, שבו כל הזמן מייצרים ומפרקים חלבונים. כל שינוי או פגימה בשלבי הייצור או המיחזור עלולים להוביל למחלות קשות. ידוע שמחלות ניווניות של עצבים כגון אלצהיימר וטרשת צדדית אמיוטרופית (ALS), למשל, מלוות בהצטברות לא תקינה של חלבונים בנוירונים. עם זאת, הטריגר מאחורי הצטברות זו נותר לא ידוע.
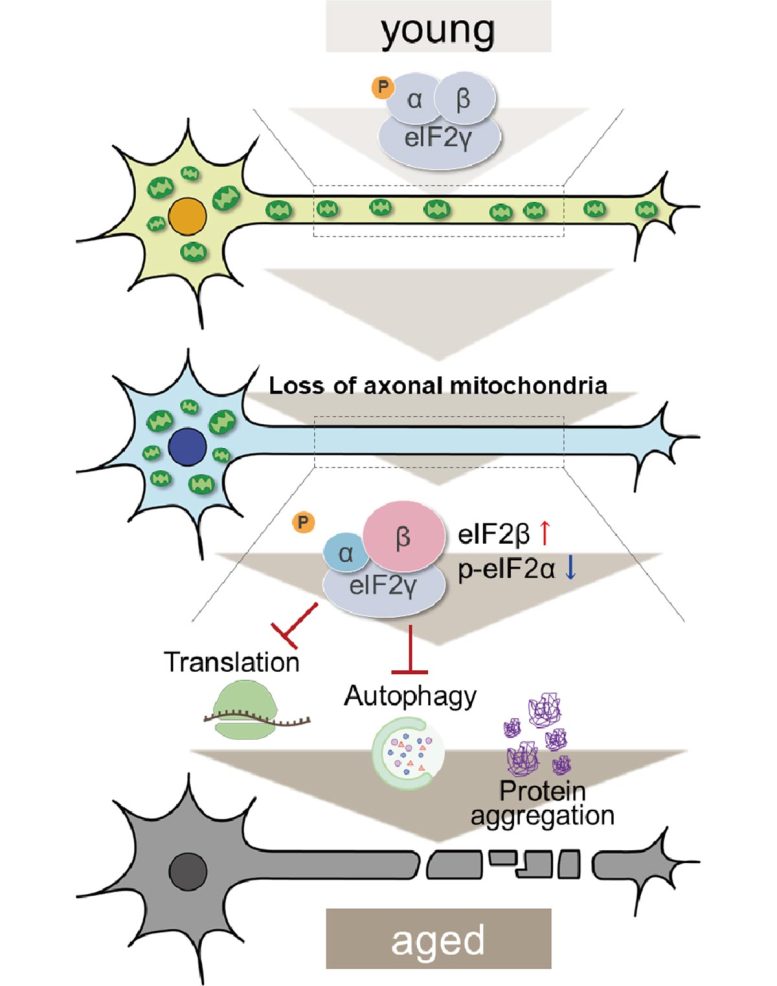
ככל שהמיטוכונדריה האקסונלית אובדת, נראים שינויים ביחידות המשנה של eIF2 אשר פוגעים בתרגום ואוטופגיה וגורמים להצטברות חלבונים בתאים. קרדיט: אוניברסיטת טוקיו מטרופוליטן
מחקר באמצעות זבובי פירות תסיסנית
צוות בראשות פרופסור חבר קאנה אנדו מאוניברסיטת טוקיו מטרופוליטן ניסה לקבוע את הגורמים להצטברות חלבון חריגה על ידי חקר זבובי פירות תסיסנית, אורגניזם מודל שנחקר נפוץ שיש לו קווי דמיון מרכזיים רבים עם הפיזיולוגיה האנושית.
הם התמקדו בנוכחות המיטוכונדריה באקסונים, הנספחים הארוכים דמויי הקנוקנות שנמתחים מתוך נוירונים ויוצרים את הקשרים הדרושים המאפשרים העברת אותות בתוך המוח שלנו. ידוע שרמות המיטוכונדריה באקסונים יכולות לרדת עם הגיל, ובמהלך התקדמות מחלות ניווניות.
ממצאים על דלדול מיטוכונדריה והצטברות חלבון
כעת, הצוות גילה שלדלדול המיטוכונדריה באקסונים יש השפעה ישירה על הצטברות חלבון. הם השתמשו בשינוי גנטי כדי לדכא את הייצור של מילטון, חלבון מפתח בהובלת המיטוכונדריה לאורך האקסונים.
נמצא שהדבר הוביל להצטברות רמות חריגות של חלבון בנוירונים של זבובי הפירות, כתוצאה מפירוק האוטופגיה, מיחזור חלבונים בתאים.
באמצעות ניתוח פרוטאומי, הם הצליחו לזהות וויסות עלייה משמעותי ב-eIF2β, תת-יחידת מפתח של קומפלקס החלבון eIF2 האחראי על התחלת ייצור (או תרגום) חלבון. גם תת-היחידה eIF2α נמצאה שעברה שינוי כימי. שתי הבעיות הללו מעכבות את הפעולה הבריאה של eIF2.
השלכות על טיפול במחלות נוירודגנרטיביות
חשוב לציין, על ידי דיכוי מלאכותי של רמות eIF2β, הצוות גילה שהם יכולים לשחזר את האוטופגיה שאבדה ולהחזיר חלק מתפקוד הנוירונים שנפגע עקב אובדן מיטוכונדריה אקסונלית. זה לא רק מראה שדלדול המיטוכונדריה באקסונים יכול לגרום להצטברות חלבון לא תקינה, אלא שזה קורה באמצעות וויסות עלייה של eIF2β.
ככל שהאוכלוסיות מתבגרות והשכיחות של מצבים ניווניים נוירו-דגנרטיביים ממשיכה לעלות, ממצאי הצוות מהווים צעד חיוני בפיתוח טיפולים למאבק במחלות קשות אלו.
עבודה זו נתמכה על ידי מענק מחקר מדעי של Sasakawa (2021-4087), קרן טקדה למדע, מענק של קרן Hoansha, פרס מחקר מקרן יפן להזדקנות ובריאות וקרן נוברטיס (יפן) לקידום המדע, מענק סיוע למחקר מדעי על מחקר מאתגר (חקר) (JSPS KAKENHI מענק מספר 19K21593), NIG-JOINT (המכון הלאומי לגנטיקה, 71A2018, 25A2019), וקרן המחקר האסטרטגי של TMU למעורבות חברתית.