מחקר עדכני שכלל מודלים חישוביים על ידי חוקרים מארבעה מוסדות בבוסטון סיפק תובנות חדשות כיצד קטמין משפיע על תפקוד המוח, במיוחד בדיכאון עמיד לטיפול. על ידי פירוט האינטראקציה של התרופה עם קולטני NMDA בקליפת המוח והדמיית השפעתה על הפעילות העצבית, המחקר מציע הבנה ברורה יותר של המנגנונים מאחורי מצבי העוררות המשתנים של קטמין והיתרונות הטיפוליים הפוטנציאליים. הממצאים עשויים להוביל ליישומים קליניים יעילים יותר ולתפיסה טובה יותר של ההשפעות הרחבות יותר של התרופה על הדינמיקה של רשתות המוח.
מחקר חדש חוקר כיצד ההשפעות של קטמין על נוירונים בודדים תורמות לשינויים משמעותיים בתפקוד רשתות המוח.
קטמין, המוכר כתרופה חיונית על ידי ארגון הבריאות העולמי, משמש למגוון מטרות כולל הרגעה, טיפול בכאב, הרדמה כללית וטיפול בדיכאון עמיד לטיפול. למרות שהשפעותיו על פעילות כלל המוח והמטרה שלו בתוך תאי המוח ידועות, הקשר בין היבטים אלו לא היה ברור. מחקר שנערך לאחרונה על ידי חוקרים מארבעה מוסדות באזור בוסטון משתמש במודלים חישוביים כדי לחקור פרטים פיזיולוגיים שקודם לכן התעלמו מהם. מחקר זה מספק תובנות חדשות לגבי המנגנונים של אופן פעולתו של קטמין.
"עבודת דוגמנות זו סייעה לפענח מנגנונים סבירים שבאמצעותם קטמין מייצר מצבי עוררות משתנים, כמו גם היתרונות הטיפוליים שלו לטיפול בדיכאון", מחבר שותף בכיר אמרי נ. בראון, אדוארד הוד טפלין פרופסור למדעי המוח החישוביים והנדסה רפואית במכון פיקוור. עבור למידה וזיכרון ב MITכמו גם רופא מרדים ב-MGH ופרופסור בבית הספר לרפואה של הרווארד.
החוקרים מ-MIT, אוניברסיטת בוסטון, בית החולים הכללי של מסצ'וסטס ואוניברסיטת הרווארד אמרו כי התחזיות של המודל שלהם, שפורסמו ב-20 במאי ב- הליכים של האקדמיה הלאומית למדעיםיכול לעזור לרופאים לעשות שימוש טוב יותר בתרופה.
"כאשר רופאים מבינים מה קורה באופן מכניסטי כשהם נותנים תרופה, הם יכולים אולי למנף את המנגנון הזה ולתמרן אותו", אמר מחבר המחקר אלי אדם, מדען מחקר ב-MIT שיצטרף בקרוב לפקולטה של בית הספר לרפואה בהרווארד וישיק מעבדה ב- MGH. "הם מקבלים תחושה כיצד לשפר את ההשפעות הטובות של התרופה וכיצד למתן את ההשפעות הרעות."
חסימת הדלת
התקדמות הליבה של המחקר כללה מודלים ביו-פיזיים של מה שקורה כאשר קטמין חוסם את קולטני "NMDA" בקליפת המוח – השכבה החיצונית שבה מתרחשות פונקציות מפתח כגון עיבוד חושי וקוגניציה. חסימת קולטני ה-NMDA מווסתת את שחרור הנוירוטרנסמיטר המעורר גלוטמט.
כאשר תעלות הנוירונים (או פתחי הדלת) המווסתות על ידי קולטני ה-NMDA נפתחות, הן בדרך כלל נסגרות לאט (כמו פתח עם סגירה הידראולית שמונעת ממנו להיטרק), ומאפשרים ליונים להיכנס ולצאת מתוך נוירונים, ובכך לווסת את התכונות החשמליות שלהם, אמר אדם. אבל, הערוצים של הקולטן יכולים להיחסם על ידי מולקולה. חסימה על ידי מגנזיום עוזרת לווסת באופן טבעי את זרימת היונים. קטמין, לעומת זאת, הוא חוסם יעיל במיוחד.
חסימה מאטה את הצטברות המתח על פני ממברנת הנוירון, שבסופו של דבר מובילה את הנוירון ל"ספייק", או לשלוח מסר אלקטרוכימי לנוירונים אחרים. פתח ה-NMDA מתבטל כאשר המתח עולה. תלות הדדית זו בין מתח, ספייק וחסימה יכולה לצייד את קולטני NMDA בפעילות מהירה יותר ממה שמהירות הסגירה האיטית שלו עשויה לרמז. המודל של הצוות הולך רחוק יותר מאלה שלפניו על ידי ייצוג האופן שבו החסימה וביטול החסימה של קטמין משפיעים על הפעילות העצבית.
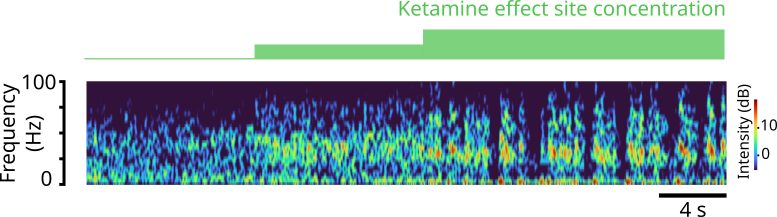
ספקטרוגרמה של תדרי קצב המוח לאורך זמן שנחזה על ידי המודל של הצוות. לאחר מנה ראשונה ומתונה של קטמין גמא כוח קצב המוח (צבעים חמים יותר) מופיע. לאחר מכן ככל שהמינון עולה, מקצבי הגמא מופסקים מעת לעת, ומשאירים רק גלי תדר נמוכים מאוד, ואז מתחדשים. קרדיט: אלי אדם, מישל מקארתי, ננסי קופל ועוד. אל.
"פרטים פיזיולוגיים שמתעלמים מהם בדרך כלל יכולים לפעמים להיות מרכזיים בהבנת תופעות קוגניטיביות", אמרה הסופרת המתכתבת ננסי קופל, פרופסור למתמטיקה ב-BU. "לדינמיקה של קולטני NMDA יש השפעה רבה יותר על דינמיקת הרשת ממה שהוערך בעבר."
בעזרת המודל שלהם, המדענים דימו כיצד מינונים שונים של קטמין המשפיעים על קולטני NMDA ישנו את הפעילות של רשת מוחית מודל. הרשת המדומה כללה סוגי נוירונים מרכזיים שנמצאו בקליפת המוח: סוג אחד מעורר ושני סוגים מעכבים. הוא מבחין בין אינטרנוירונים "טוניקים" שמפחיתים את פעילות הרשת לבין אינטרנוירונים "פאזיים" המגיבים יותר לנוירונים מעוררים.
ההדמיות של הצוות שיחזרו בהצלחה את גלי המוח האמיתיים שנמדדו באמצעות אלקטרודות EEG על קרקפתו של מתנדב אנושי שקיבל מנות שונות של קטמין ואת ספייק העצבים שנמדד בבעלי חיים שטופלו באופן דומה שהשתלו להם מערכי אלקטרודות. במינונים נמוכים, קטמין הגביר את עוצמת גלי המוח בטווח תדרי הגמא המהיר (30-40 הרץ). במינונים הגבוהים יותר שגורמים לאיבוד הכרה, גלי גמא אלה הופסקו מעת לעת על ידי מצבי "ירידה" שבהם מתרחשים רק גלי דלתא בתדר איטי מאוד. הפרעה חוזרת ונשנית זו של הגלים בתדר גבוה יותר היא מה שיכול לשבש את התקשורת על פני הקורטקס מספיק כדי לשבש את התודעה.
אבל איך? ממצאי מפתח
חשוב לציין, באמצעות סימולציות, הם הסבירו כמה מנגנוני מפתח ברשת שייצרו בדיוק את הדינמיקה הזו.
התחזית הראשונה היא שקטמין יכול לעכב את פעילות הרשת על ידי כיבוי אינטרנוירונים מעכבים מסוימים. המודלים מראים שהקינטיקה הטבעית של החסימה וביטול החסימה של קולטני NMDA יכולה להכניס זרם קטן כאשר הנוירונים אינם מתפצלים. נוירונים רבים ברשת שנמצאים ברמת הגירוי הנכונה יסתמכו על הזרם הזה שיתגבר באופן ספונטני. אבל כאשר קטמין פוגע בקינטיקה של קולטני ה-NMDA, הוא מרווה את הזרם הזה ומשאיר את הנוירונים האלה מדוכאים. במודל, בעוד שקטמין פוגע באותה מידה בכל הנוירונים, אלו הנוירונים המעכבים את הטוניק שנסגרים בגלל שהם במקרה ברמת עירור זו. זה משחרר נוירונים אחרים, מעוררים או מעכבים מהעיכוב שלהם, מה שמאפשר להם לעלות במרץ ולהוביל למצב המוח הנרגש של קטמין. העירור המוגבר של הרשת יכול אז לאפשר ביטול חסימה מהיר (וחסימה מחדש) של קולטני ה-NMDA של הנוירונים, ולגרום להתפרצויות של ספייק.
תחזית נוספת היא שההתפרצויות הללו מסתנכרנות לתוך גלי תדר הגמא הנראים עם קטמין. אֵיך? הצוות מצא שהאינטרנוירונים המעכבים הפאזיים מעוררים על ידי קלט רב של הנוירוטרנסמיטר גלוטמט מהנוירונים המעוררים וזינוק נמרץ, או אש. כשהם עושים זאת, הם שולחים אות מעכב של המוליך העצבי GABA לנוירונים המעוררים שמדכאים את הירי המעורר, כמעט כמו גננת שמרגיעה כיתה שלמה של ילדים נרגשים. אות העצירה הזה, שמגיע לכל הנוירונים המעוררים בו זמנית, נמשך רק כל כך הרבה זמן, בסופו של דבר מסנכרן את הפעילות שלהם, מייצר גל גמא מוחי מתואם.
"הממצא שקולטן סינפטי אינדיבידואלי (NMDA) יכול לייצר תנודות גמא ושתנודות גמא אלו יכולות להשפיע על גמא ברמת הרשת היה בלתי צפוי", אמרה הסופרת המקבילה מישל מקארתי, עוזרת מחקר למתמטיקה ב-BU. "זה נמצא רק על ידי שימוש במודל פיזיולוגי מפורט של הקולטן NMDA. רמה זו של פירוט פיזיולוגי חשפה סולם זמן גמא שאינו קשור בדרך כלל לקולטן NMDA."
אז מה לגבי מצבי הירידה התקופתיים שמופיעים במינוני קטמין גבוהים יותר, מעוררי חוסר הכרה? בסימולציה, פעילות תדר הגמא של הנוירונים המעוררים לא יכולה להישמר במשך זמן רב מדי על ידי הקינטיקה הפגומה של קולטן NMDA. הנוירונים המעוררים למעשה מותשים תחת עיכוב GABA מהאינטרנוירונים הפאזיים. זה מייצר את המצב למטה. אבל אז, אחרי שהם הפסיקו לשלוח גלוטמט לאינטרנוירונים הפאזיים, התאים האלה מפסיקים לייצר את אותות ה-GABA המעכבים שלהם. זה מאפשר לנוירונים המעוררים להתאושש, להתחיל מחזור מחדש.
חיבור נוגד דיכאון?
המודל עושה תחזית נוספת שעשויה לעזור להסביר כיצד קטמין מפעיל את השפעותיו נוגדות הדיכאון. זה מצביע על כך שפעילות הגמא המוגברת של קטמין עלולה לגרום לפעילות גמא בקרב נוירונים המבטאים פפטיד הנקרא VIP. לפפטיד זה נמצאה השפעות מקדמות בריאות, כמו הפחתת דלקת, שנמשכות הרבה יותר זמן מהשפעות קטמין על קולטני NMDA. צוות המחקר מציע כי הסחף של נוירונים אלה תחת קטמין עשוי להגביר את שחרור הפפטיד המועיל, כפי שנצפה כאשר תאים אלה מעוררים בניסויים. זה גם מרמז על תכונות טיפוליות של קטמין שעשויות לחרוג מהשפעות נוגדות דיכאון. עם זאת, צוות המחקר מכיר בכך שהקשר הזה הוא ספקולטיבי וממתין לאימות ניסוי ספציפי.
"ההבנה שהפרטים התת-תאיים של קולטן ה-NMDA יכולים להוביל לתנודות גמא מוגברות הייתה הבסיס לתיאוריה חדשה לגבי האופן שבו קטמין עשוי לפעול לטיפול בדיכאון", אמר קופל.
מחברים שותפים נוספים של המחקר הם מרק קובלסקי, Oluwaseun Akeju, וארל ק. מילר.
קרן JPB, מכון פיקאוור ללמידה וזיכרון, מרכז סימונס למוח החברתי, המכונים הלאומיים לבריאותג'ורג' ג'יי אלבאום (MIT '59, SM '63, PhD '67), מימי ג'נסן, דיאן ב. גרין (MIT, SM '78), מנדל רוזנבלום, ביל סוונסון ותורמים שנתיים לקרן יוזמת ההרדמה תמכו ב- מחקר.

