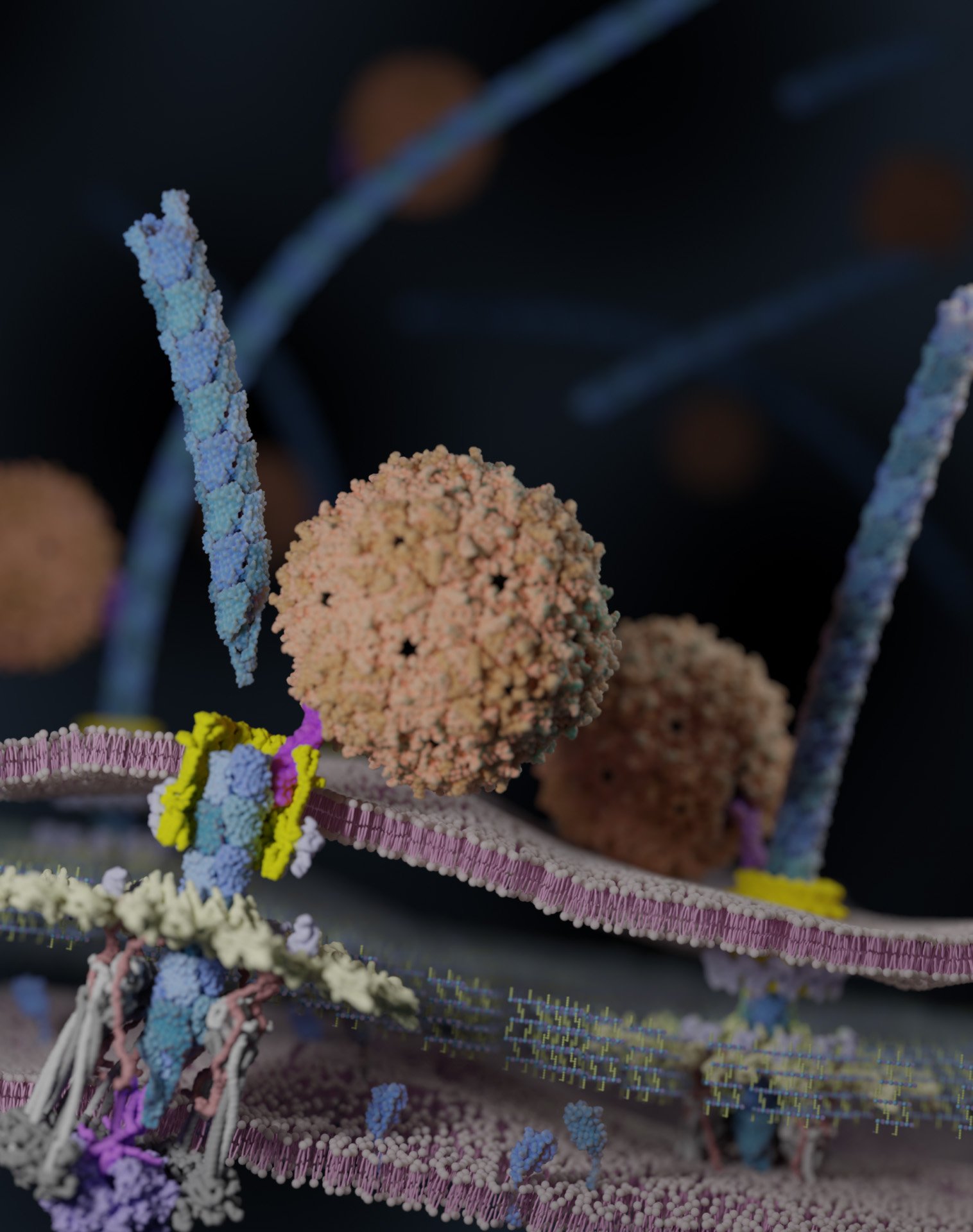
תיאור של בקטריופאג PP7 (כתום) על פני התא של Pseudomonas aeruginosa המנתק את הפילוס (כחול) של החיידק. החוקרים זיהו מבני חלבון ואינטראקציות באמצעות מיקרוסקופ פלואורסצנטי, מיקרוסקופיה קריוגנית-אלקטרונית והדמיות חישוביות. תמונה זו נגזרת על סמך ממצאי הצוות. קרדיט: Jirapat Thongchol/Texas A&M AgriLife
מחקר חדש מפרט מנגנונים ומבנים שחיפשו זמן רב.
זיהומים חיידקיים מציגים מכשולים גדולים הן בחקלאות והן בשירותי הבריאות, במיוחד עם השכיחות הגוברת של חיידקים עמידים לאנטיביוטיקה. חוקרים ב-Texas A&M AgriLife Research חוקרים כיצד וירוסים שמדביקים חיידקים מנטרלים את הפתוגנים המזיקים הללו, ופותחים את הדלת לגישות טיפול חדשניות.
במחקר האחרון שלהם שפורסם ב מַדָעLanying Zeng, Ph.D., פרופסור וג'ונג'י Zhang, Ph.D., פרופסור חבר, שניהם במחלקה לביוכימיה וביופיזיקה של טקסס A&M College of Agriculture and Life Science, פירטו מנגנון מדויק שבאמצעותו הפאג'ים משביתים בַּקטֶרִיָה.
המאמץ המשותף כלל גם:
- Yiruo Lin, Ph.D., עוזר מחקר במחלקה להנדסה של מכללת טקסס A&M למדעי המחשב והנדסת המחשב.
- מתיאס קוך, Ph.D., עוזר פרופסור במחלקה לביולוגיה של טקסס A&M College of Arts and Sciences.
- זמר גיתאי, Ph.D., ויהושע שייביץ, Ph.D., פרופסורים ב- אוניברסיטת פרינסטון המחלקה לביולוגיה מולקולרית ומחלקה לפיזיקה, בהתאמה.
- Yinghao Wu, Ph.D., פרופסור חבר במכללת אלברט איינשטיין לרפואה במחלקה למערכות וביולוגיה חישובית.
יחד, הצוות עבד כדי להסביר סדרה של אינטראקציות שמדענים ביקשו להבין מאז תחילת שנות ה-70.
הצורך בטיפולים חדשים
Pseudomonas aeruginosa הוא סוג של חיידקים שעלולים לגרום לזיהומים בדם, בריאות ולעתים בחלקים אחרים בגוף. זיהומים אלו שכיחים במיוחד במסגרות בריאות, אשר לעיתים קרובות נתקלות בחיידקים עמידים לתרופות. על פי המרכז לבקרת מחלות ומניעתן, היו למעלה מ-30,000 מקרים של זיהומי P. aeruginosa עמידים לריבוי תרופות בקרב חולים מאושפזים ב-2017.
השכיחות של זיהומי Pseudomonas עמידים לאנטיביוטיקה הופכת אותם לנקודת מיקוד מעשית לטיפול בפאג'ים, סוג של שיטת טיפול באמצעות בקטריופאג'ים, או פאג'ים, שחוקרים במרכז טקסס A&M לטכנולוגיית פאג'ים בוחנים כחלופה לתרופות טיפוסיות.
זנג וג'אנג, מנהלים משותפים במרכז יחד עם ג'ייסון גיל, Ph.D., פרופסור חבר במחלקה למדעי בעלי החיים, בוחנים את התועלת של הפאג'ים, אפילו מעבר לטיפול בפאג'ים, על ידי צלילה לתוך המבנים והמנגנונים הפועלים. .
מיקוד לפילוס
אחד הגורמים המאפשרים ל-P. aeruginosa להעביר גנים עמידים לחיידקים זה בזה, כמו גם להסתובב וליצור מבנים קשים לטיפול הנקראים ביופילמים, הוא תוספת הנקראת פילוס, על שם המילה הלטינית לחנית. מבנים גליליים אלה משתרעים מפני השטח של חיידקים.
חלק מהפאגים עושים שימוש בפילי חיידקים על ידי היצמדות אליהם ומאפשרים לחיידקים לגלגל את הפאג' אל פני השטח, שם הפאג' יכול להתחיל להדביק את החיידקים.

משמאל לימין: Lanying Zeng, Ph.D., Junjie Zhang, Ph.D., Zihao Yu, ו-Jirapat Thongchol. יחד עם אחרים, חוקרים אלו במרכז טקסס A&M לטכנולוגיית פאג'ים מחפשים פתרונות לזיהומים חיידקיים עמידים לאנטיביוטיקה ואפיון אינטראקציות בין פאג' לחיידק. קרדיט: Zihao Yu/Texas A&M AgriLife
במחקר שלהם ב מַדָע, שנכתב לראשונה על ידי הסטודנטים לתארים מתקדמים מטקסס A&M Jirapat Thongchol ו-Zihao Yu, החוקרים למדו תהליך זה צעד אחר צעד באמצעות מיקרוסקופיה פלואורסצנטית, מיקרוסקופיה קריוגני-אלקטרונים ומודלים חישוביים. הם צפו כיצד פאג בשם PP7 מדביק את P. aeruginosa על ידי התקשרות לפילוס, אשר לאחר מכן נסוג ומושך את הפאג אל פני התא.
בנקודת הכניסה ל- נגיףהפילוס מתכופף ומתנתק, ואובדן הפילוס גורם ל-P. aeruginosa להיות הרבה פחות מסוגל להדביק את המארח של עצמו.
מחקר מתמשך
עבודה זו היא המשך למחקר קודם שפורסם בשנת 2020, כאשר הצוות של זנג מצא פאג' שיכול באופן דומה לשבור את ה-pili של תאי E. coli, ולמנוע מהחיידקים לחלוק גנים זה עם זה – דרך נפוצה שבה עמידות לאנטיביוטיקה מתפשטת.
ה מַדָע המחקר על Pseudomonas הוא חלק מהחבילה האחרונה של מחקרים של הצוות. בחודש שעבר (מרץ 2024), הם פרסמו ממצאים ב תקשורת טבע על האינטראקציה בין סוג אחר של חיידקים, Acinetobacter, לבין פאג שמדביק אותו. מחקר נוסף, שצפוי להתפרסם בחודש הבא, יכסה סוג שלישי של חיידקים ופאג'ים נוספים.
ההתקדמות של הצוות בקביעת מבני חלבון מדויקים ואינטראקציות מולקולריות התאפשרה עם מיקרוסקופ הקריו-אלקטרון החדש של AgriLife Research, שנפתח בטקסס A&M בסוף 2022 ויכול לפתור מבנים ברמה האטומית.
"במחקר הקודם שלנו על E. coli, לא באמת חקרנו הרבה על המנגנון", אמר זנג. "במחקר שלנו על Pseudomonas, הצלחנו להסביר הרבה יותר על מה בדיוק קורה, כולל הכוח והמהירות של ניתוק הפילוס, ולהבין מדוע וכיצד זה קורה."
שימושים ברפואה
ההשלכות של מחקר מתמשך זה עשויות להתגלות כחשובות בטיפול בזיהומים אנטי-מיקרוביאליים. ג'אנג אמר כי הרופאים לא יצטרכו להשתמש בפאג'ים כדי להרוג את החיידקים – כפי שנעשה בטיפול בפאג' – אלא יכולים פשוט לאפשר לנגיפים לפרק את החיידקים מנשקם, מה שעשוי לתת למערכת החיסון הזדמנות להילחם בזיהום בעצמה או לאפשר רופאים לטפל בחולים עם מינונים נמוכים יותר של אנטיביוטיקה.
"אם אתה פשוט הורג את החיידקים, אתה שובר את התאים, והם ישחררו חומר רעיל מתוך התא לתוך המארח," אמר ג'אנג. "הגישה שלנו היא להשתמש בסוג מסוים של פאג'ים שמנטרל את החיידקים מנשקם. אנחנו מסירים את היכולת שלהם להחליף גנים עמידים לתרופות או לנוע על ידי ניתוק התוספת הזו".
צוות מדעני הפאג' אמר שהם ימשיכו לחפש מקרים דומים של פאגים המדכאים את הארסיות של חיידקים פתוגניים.
"אנחנו נוקטים בגישה סינרגטית," אמר ג'אנג. "אנחנו מנסים להבין מנגנון אוניברסלי לסוג זה של פאג'ים וכיצד הם מסוגלים להשפיע על סוגים אחרים של חיידקים. זו המטרה הכוללת של המאמץ המשותף שלנו: לנסות להתמודד עם הבעיה של חיידקים עמידים לריבוי תרופות".