חוקרים חוקרים בקטריופאג'ים, במיוחד פאגים "ג'מבו" בעלי גנום גדול, ככלים פוטנציאליים למאבק בחיידקים עמידים לאנטיביוטיקה. הפאג'ים הללו עשויים להיות מהונדסים כדי לספק אנטיביוטיקה ישירות לזיהומים, ומציעים אסטרטגיה חדשה במאבק בפתוגנים קטלניים.
בתחילת המאה ה-20 זכתה האנטיביוטיקה להכרה נרחבת כטיפול יעיל לזיהומים חיידקיים. במה שנחשב בתור תור הזהב האנטיביוטי, הם פותחו באופן קבוע לאורך אמצע המאה ה-20. עם זאת, תור הזהב הזה לא נמשך.
ככל שנקבעו אנטיביוטיקה בתדירות גבוהה יותר, התפתחו חיידקים. הם הפכו מצוידים יותר להביס את האנטיביוטיקה, מה שהפך רבים לחסרי תועלת. הירידה החדה ביעילות האנטיביוטיקה נמשכה והביאה למשבר העמידות לאנטיביוטיקה של היום.
פוטנציאל טיפולי של פאג'ים ג'מבו
מדענים מסתכלים כעת על בעל ברית יוצא דופן, וירוסים, כדי לעזור להתמודד עם האיום הגובר הזה. לאחרונה, החוקרים התמקדו בווירוסים הידועים בשם בקטריופאג'ים ככלי חדש לטיפול ופירוק של חיידקים עמידים לאנטיביוטיקה. תשומת לב מיוחדת הושמה לפאג'ים "ג'מבו" – וירוסים שהתגלו לאחרונה עם גנומים גדולים במיוחד – שניתן להשתמש בהם כחומרי מסירה מיוחדים שיכולים לא רק להרוג חיידקים, אלא גם להיות מהונדסים כדי להעביר אנטיביוטיקה ישירות למקור הזיהום.
אבל כדי לספק טיפולים חדשים דרך הפאג', על המדענים להבין תחילה את ההרכב והמנגנונים הביולוגיים יוצאי הדופן בתוך הנגיפים המסתוריים הללו.
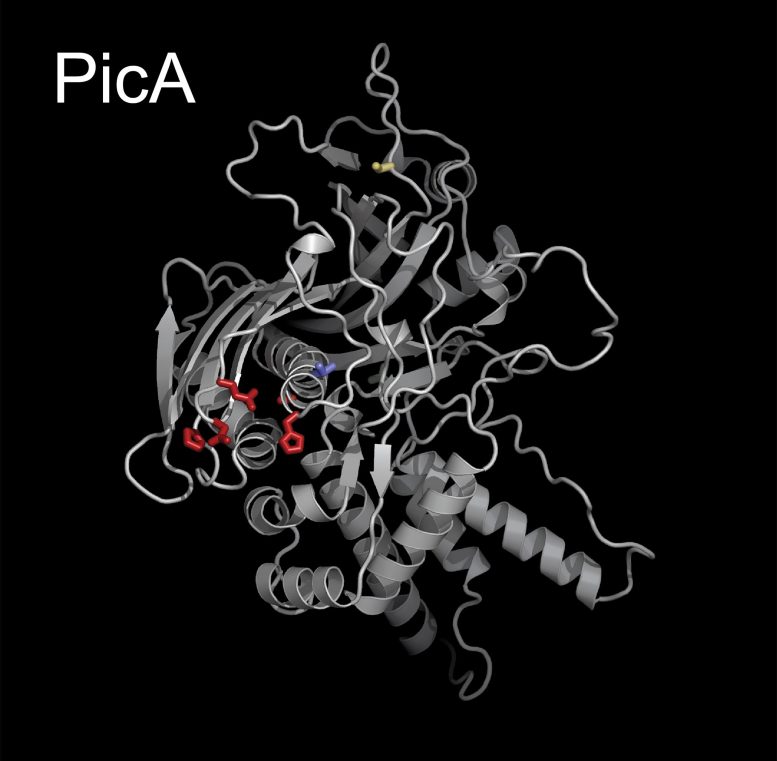
תמונה גרפית של PicA, מרכיב מפתח בפאג ג'מבו שמתאם סחר בחלבונים על פני המעטפת המגנה של גרעין הפאג'. קרדיט: Pogliano Labs, UC San Diego
מחקר וממצאים
חוקרי בית הספר למדעי הביולוגיה של אוניברסיטת קליפורניה בסן דייגו ועמיתיהם במכון הגנומיקס החדשני של UC ברקלי ובאוניברסיטת צ'וללונגקורן בבנגקוק עשו צעד משמעותי קדימה בפענוח מספר פונקציות מפתח בתוך פאג'ים ג'מבו.
"לפאגי הג'מבו האלה יש גנומים גדולים שבתיאוריה ניתן לתמרן אותם כדי לשאת מטענים שהורגים חיידקים בצורה יעילה יותר", אמר ג'ו פוגליאנו, פרופסור באוניברסיטת סן דייגו בבית הספר למדעי הביולוגיה ומחבר בכיר של המאמר החדש, שפורסם לאחרונה. בתוך ה הליכים של האקדמיה הלאומית למדעים. "הבעיה היא שהגנום שלהם סגור ולכן לא קל לגשת אליו. אבל עכשיו גילינו כמה מהמרכיבים המרכזיים שלו".
כפי שתואר במאמר, מחקר בראשות בית הספר למדעי הביולוגיה הסטודנט צ'ייס מורגן התמקד בפאג'ים ג'מבו Chimalliviridae שנמצאו משתכפלים בתוך חיידקים על ידי יצירת תא הדומה לגרעין שבתוך תאים של בני אדם ואורגניזמים חיים אחרים. התא דמוי הגרעין של Chimalliviridae מפריד ומייבא באופן סלקטיבי חלבונים מסוימים המאפשרים לה להתרבות בתוך החיידק המארח. אבל אֵיך תהליך זה מתפתח היה חלק תמוה בתהליך.

נגיף הג'מבו phikzvirus, או phiKZ, ידוע כמדביק חיידקי Pseudomonas. קרדיט: Pogliano Labs, UC San Diego
באמצעות כלים גנטיים וביולוגיים חדשים של התא, מורגן ועמיתיו זיהו חלבון מפתח, שאותו הם כינו "יבואן חלבון של Chimalliviruses A", או PicA, שפועל כסוג של סדרן מועדוני לילה, סחר סלקטיבי בחלבונים על ידי מתן כניסה לגרעין עבור חלקם אך מונעים גישה לאחרים. PicA, הם גילו, מתאם סחר בחלבון מטען על פני מעטפת המגן של גרעין הפאג'.
"רק העובדה שזה נגיף היא מסוגלת להקים את המבנה המורכב להפליא הזה ומערכת התחבורה היא באמת מדהימה ושכמותה לא ראינו בעבר", אמר מורגן. "מה שאנו חושבים על ביולוגיה מורכבת שמור בדרך כלל לצורות חיים גבוהות יותר עם בני אדם ועשרות אלפי הגנים שלנו, אבל כאן אנו רואים תהליכים אנלוגיים מבחינה תפקודית בגנום ויראלי זעיר יחסית של כ-300 גנים בלבד. זו כנראה מערכת התחבורה הסלקטיבית הפשוטה ביותר שאנו מכירים."
שימוש ב-CRISPRI-ART, מתכנת RNA כלי לחקר גנומים, החוקרים הצליחו להוכיח כי PicA הוא מרכיב חיוני בתהליך הפיתוח והשכפול של גרעין Chimalliviridae.
"ללא הפשטות והרבגוניות של טכנולוגיות CRISPR המכוונות ל-RNA, שאלה ותשובה ישירה לשאלות אלו יהיה כמעט בלתי אפשרי. אנחנו באמת נרגשים לראות כיצד הכלים הללו מפעמים את התעלומות המקודדות על ידי גנום הפאג'", אמר מחבר שותף בן אדלר, חוקר פוסט-דוקטורט שעובד תחת חלוצת CRISPR זוכת פרס נובל, ג'ניפר דאודנה.

הסטודנטים הבוגרים של בית הספר למדעי הביולוגיה, צ'ייס מורגן ואמילי ארמברוסטר, מחברי המאמר PNAS. קרדיט: Pogliano Labs, UC San Diego
השלכות על טיפול בפאג'
חיידקים ווירוסים מעורבים בסוג של מרוץ חימוש במשך מיליארדי שנים, כל אחד מתפתח כדי להתמודד עם ההסתגלות של השני. החוקרים אומרים שמערכת התחבורה המתוחכמת PicA היא תוצאה של אותה תחרות אבולוציונית עזה ומתמשכת. המערכת התפתחה להיות גמישה מאוד וגם סלקטיבית מאוד, המאפשרת רק אלמנטים מועילים מרכזיים בתוך הגרעין. ללא מערכת PicA, החלבונים ההגנתיים של החיידק יפעלו פנימה ויחבלו בתהליך השכפול של הנגיף.
מידע כזה הוא חיוני שכן מדענים עם יוזמת פתוגנים מתעוררים במימון הווארד יוז (HHMI) והמרכז ליישומי פאג'ים חדשניים וטיפולים של אוניברסיטת קליפורניה בסן דייגו שואפים להניח את הבסיס לתוכנית גנטית של פאג'ים בסופו של דבר לטיפול במגוון מחלות קטלניות.
"באמת לא הייתה לנו כל הבנה כיצד עבדה מערכת ייבוא החלבונים או אילו חלבונים היו מעורבים בעבר, כך שהמחקר הזה הוא הצעד הראשון בהבנת תהליך מפתח שהוא קריטי עבור הפאג'ים הללו כדי לשכפל בהצלחה," אמר בית הספר למדעי הביולוגיה. סטודנטית לתואר שני אמילי ארמברוסטר, מחברת שותפה. "ככל שנבין יותר את המערכות החיוניות הללו, כך נוכל להנדס פאג' טוב יותר לשימוש טיפולי.
יעדים עתידיים עבור וירוסים מתוכנתים גנטית כאלה כוללים Pseudomonas aeruginosa חיידקים, הידועים כגורמים לזיהומים שעלולים להיות קטלניים ומהווים סיכונים לחולים בבתי חולים. מטרות מבטיחות אחרות כוללות E. coli ו-Klebsiella שעלולים לגרום לזיהומים כרוניים וחוזרים, ובמקרים מסוימים, להיכנס לזרם הדם שעלול להיות מסכן חיים.