וירוס הפטיטיס B (HBV) מדביק כ-296 מיליון אנשים וגורם לתמותה משמעותית, מה שמוביל לשחמת הכבד או לסרטן מכיוון שהוא מתמקד בכבד עם מעט תסמינים בתחילה. מחקרים עדכניים חשפו מנגנונים חדשים של חלבון הפולימראז של HBV, שיכולים להוביל לטיפולים חדשניים, שעלולים לעבור מעבר למגבלות הטיפולים הנוכחיים שמצליחים להתמודד עם הזיהום אבל לא לחסל אותו.
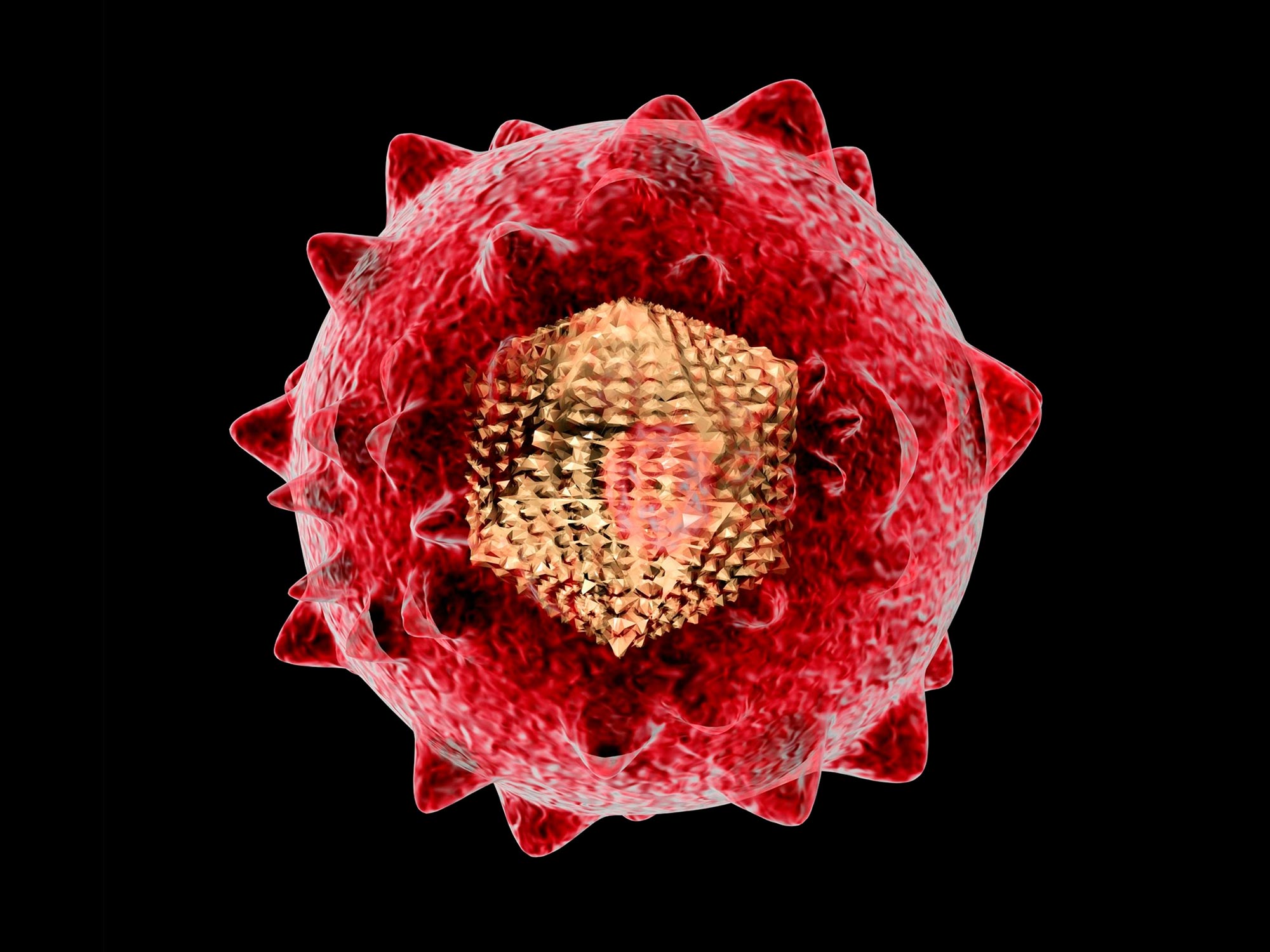
הפטיטיס B נגיף (HBV) הוא זעיר, מסוכן ומדבק מאוד. זה מדביק באופן כרוני כ-296 מיליון אנשים וגבה כמיליון חיים מדי שנה. הנגיף החמקמק הזה מכוון לכבד, ולעתים קרובות נשאר ללא סימפטומים עד שהוא מוביל לשחמת או סרטן.
רוב הטיפולים מנסים לעכב את חלבון הפולימראז (פול) של הנגיף. אבל הטיפולים האלה הם לכל החיים ולא מרפאים. כעת חוקרים מהמעבדה של צ'ארלס מ. רייס של רוקפלר חשפו מנגנונים שטרם נראו ועשויים להוביל לגישות טיפוליות חדשות עבור HBV. הם פרסמו את התוצאות ב תָא.
"המעכבים הנוכחיים יכולים להפחית את הזיהום אבל לא יכולים למגר אותו", אומר ביל שניידר, עוזר מחקר במעבדה לווירולוגיה ומחלות זיהומיות של רייס, ומחבר בכיר במאמר. "מדע בסיסי יכול לספק תובנות חדשות ולהוביל לאסטרטגיות שונות. זו הסיבה שחזרנו ללוח השרטוטים כדי ללמוד עוד על הנגיף הזה".
אורגניזם יוצא דופן
גנום HBV הוא יצירת מופת של כלכלה – וכתוצאה מכך הוא שמרני בצורה יוצאת דופן. יותר ממחציתו מכיל מסגרות קריאה חופפות, אזורים שבהם נוקלאוטידים מקודדים ליותר מחלבון אחד. מכיוון שמוטציה בודדת בתוך אחת מהמסגרות הללו יכולה להוביל לשינוי באחרת, הנגיף חייב לשמור על שליטה קפדנית על אזורים אלה המחוברים באופן מורכב כדי למנוע השפעות שעלולות להיות קטסטרופליות.
ובכל זאת, HBV גמיש מספיק כדי להסתגל לסביבות ולמארחים חדשים. "זהו וירוס מוצלח מאוד בבני אדם, וקרוביו הקרובים מדביקים מגוון של ציפורים ויונקים", אומר שניידר.
האופן שבו HBV מנהל את האיזון העדין הזה בין קשיחות גנטית וגמישות הובנה בצורה גרועה, מכיוון שקשה להפריד את המסגרות החופפות הללו. הפעולה הקולקטיבית שלהם מסתירה את המנגנונים של חלבונים בודדים.
זמן רב על הרדאר של החוקרים נמצא חלבון הפול, הממלא תפקידים חיוניים בשכפול HBV. מולקולה רב תכליתית, חשיבותה מתבטאת בגודלה; הוא גדול בהרבה מחלבונים ויראליים אחרים ועוטף שני שליש מהגנום המעגלי של HBV, חולק את אחת ממסגרות הקריאה החופפות עם שלושה חלבונים אחרים.
כדי להבין טוב יותר את המרכיבים הדינמיים שלה, הצוות של רייס השתמש בגישה חדשה שפיתחו בשנה שעברה ומספקת RNA לתוך תאים מתורבתים כדי לייצר ויראלי DNA, חלבונים ומוצרים אחרים. הגישה אפשרה להם לנתק, או להפריד, את הפונקציות של חלבונים במסגרות קריאה חופפות ולקבל מבט ברור יותר על פול.
"דמיין שני גיליונות נייר שקופים עם טקסט שונה מוערמים זה על זה. אם תוכל להסיר את אחד הגיליונות, יהיה קל יותר לקרוא אותו", אומר שניידר. "זה מה שמערכת אספקת ה-RNA הזו מאפשרת לנו לעשות."
לאחר מכן, הם השתמשו בסריקת מוטציות עמוקה – שיטת תפוקה גבוהה שיכולה לחשוף את המכניקה וההתנהגויות של עשרות אלפי גרסאות חלבון. זה אפשר להם לבדוק כמעט כל וריאנט אפשרי בחלבון הפול ולראות איך הוא מגיב לכל שינוי.
ריבוזומים תקועים
אחת התגליות הבלתי צפויות הראשונות שלהם הייתה הדרישה המחמירה ל חומצות אמינו נקראים פרולינים סמוך לקצה חלבון הפול. ידוע כי המולקולות הנוקשות הללו מאטות את הריבוזומים, המכונות המולקולריות שמייצרות חלבונים על ידי נסיעה לאורכה של מולקולת RNA שליח ותרגום קוד לשרשראות של חומצות אמינו. פרולינים מרובים ברציפות יכולים לעצור את הריבוזום במסלולו. וכאשר ריבוזום נעצר במקום מסוים בקוד, הוא חוסם זמנית את התרגום.
אין ספק, הם גילו שריבוזומים שבונים את חלבון הפול נעצרו ממש לפני הסוף, והותירו את החלבון קשור לריבוזום כמו בלון קשור בידו של ילד.
"זה פשוט לא הרפה מזה", אומר שניידר.
הם מציעים שהעצירה הזו עשויה לתת לחלבון זמן להתקפל כראוי כדי לבצע את תפקידו, וחשוב מכך, להגדיל את הסיכוי שהוא ייקשר ל-RNA הנכון – זה שקודד לו. רק אז החלבון משתחרר.
מכוונים ליעדים חדשים
זה זמן רב ידוע שחלבון הפול מעדיף לתמלל לאחור את ה-RNA שממנו הוא מקורו (המכונה cis-preference) במקום למצוא RNA אחר להעתיק, אבל איך הוא השיג את זה – באמצעות עצירת ריבוזום – לא היה ידוע עד כה.
תהליך זה עשוי להיות דרך לחלבון הפול להפיץ רק RNA מוכחים – דוגמה לכך שאם הוא נשבר, אל תעתיקו אותו. או שזה יכול להיות בשביל היעילות.
"לא מייצרים הרבה חלבוני פול, אז הנגיף רוצה לוודא שכאשר נוצר אחד, הוא יכול לעשות את העבודה שלו", הוא אומר. "מנגנון ההעדפה של ה-cis על ידי קשירה כנראה עוזר להבטיח שהחלבון לא רק מרחף בתא ומחפש את ה-RNA המזוהה שלו. זה תהליך יעיל יותר".
בשלב הבא של המחקר שלהם, הם יחקרו כיצד לתמרן את העדפת ה-cis-של פול. "ברגע שאתה מבין מנגנון, יש לך את היכולת להפריע לו ולגלות מה ההשלכות", הוא אומר.
רעיון אחד הוא למנוע עצירת ריבוזום על ידי מוטציה של הפרולינים המעוררים את ההפסקה. "זה כנראה יעכב את הנגיף, וזה עשוי להקשות על הנגיף לפתח עמידות לתרופות", הוא אומר.